丸山ワクチン(Specific Substance Maruyama; SSM)は結核菌由来の抽出物から作られた免疫賦活剤です。1950〜60年代に研究を始めた皮膚科医・丸山千里博士が、結核患者やハンセン病患者にがんが少ないことに着目して開発しました。現在も日本国内で多くのがん患者が希望により使用していますが、抗がん剤として正式に承認されておらず、有償治験薬という扱いのまま半世紀以上経過しています。本稿では、その歴史、臨床試験の結果、安全性、そして社会的な議論を解説します。
開発の歴史と社会的背景
丸山ワクチンは第二次世界大戦中の結核治療研究から生まれました。時系列で主要な出来事を振り返ります。
- 1944年 – 丸山千里博士が結核菌から毒性物質を除いた抽出物を作成。皮膚結核やハンセン病の治療に用いられ、症状改善が見られたことから「丸山ワクチン」と呼ばれるようになりました。
- 1966年 – 日本皮膚科学会雑誌に初報を掲載。疣贅や皮膚がん患者で組織増殖を抑える効果があると報告しました。
- 1968年 – 『日本医事新報』に158例の悪性腫瘍患者への投与成績(著効30例、有効68例)を発表し、大きな話題となりました。以後口コミで全国に広がり、患者・家族による署名活動も起こります。
- 1976年 – 製造元のゼリア新薬工業が抗悪性腫瘍剤として厚生省に承認申請。愛知県がんセンターや東北大学で臨床試験が行われましたが、腫瘍縮小効果は小さく、生存延長も限定的でした。
- 1981年 – 中央薬事審議会は「有効性を確認できない」と答申し不承認となりました。ただし患者の強い要望を考慮し、例外的に実費を負担する条件で使用が認められ、有償治験薬として現在に至ります。
- 1990年代 – 婦人科領域で免疫賦活剤「Z‑100」(丸山ワクチンと同成分)の臨床試験が実施され、二重盲検比較試験などで用量設定や効果検証が行われました。
- 2002–2004年 – プラセボ対照第Ⅲ相試験が行われましたが、主要評価項目(全生存期間)で統計的有意差は得られませんでした。
- 2020年代 – アジア7か国を対象とする国際共同試験が完了したと報じられていますが、2025年9月時点で査読付き論文は発表されていません。したがって現時点でも標準治療としての承認は得られていません。
丸山ワクチンは患者の要望と行政の慎重な姿勢の板挟みの中で「特例的な治験薬」として存続してきました。副作用が少ないことから体験談で支持される一方、科学的な裏付けが乏しいことが社会的議論を生み続けています。
臨床試験と有効性の検証
丸山ワクチンの抗がん効果を検証する臨床試験は幾つか実施されましたが、明確な延命効果や腫瘍縮小効果を示すエビデンスは限られています。代表的な試験を表にまとめました。表の内容は主要論文から抽出した概略であり、各群の詳細な統計解析は原論文をご覧ください。

生存率を可視化するグラフ
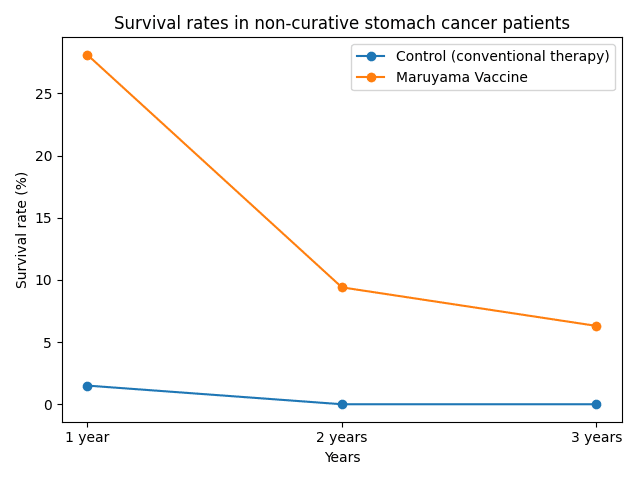
非治癒切除胃がん症例の試験では、生存率の改善が報告されたものの症例数が少なく統計的な有意差は示せませんでした。下図は化学療法単独群と丸山ワクチン併用群の生存率の違いを示しています(出典:1980年Chemotherapy)。
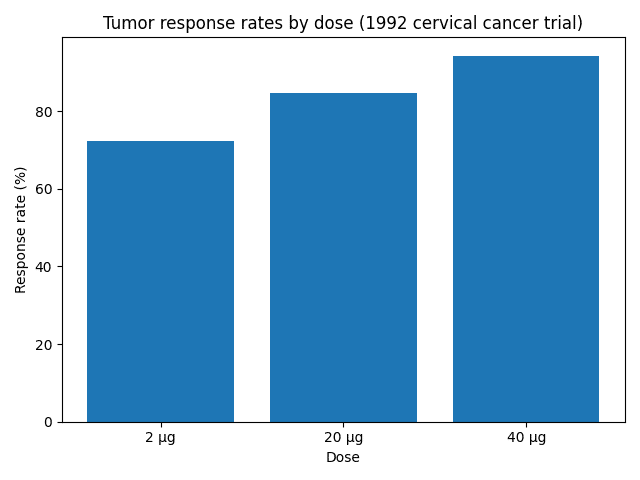
子宮頸がんを対象とした第Ⅱ相試験では用量と奏効率が相関する結果が得られましたが、生存期間の延長は認められませんでした。投与量と奏効率の関係を図示すると以下のとおりです。
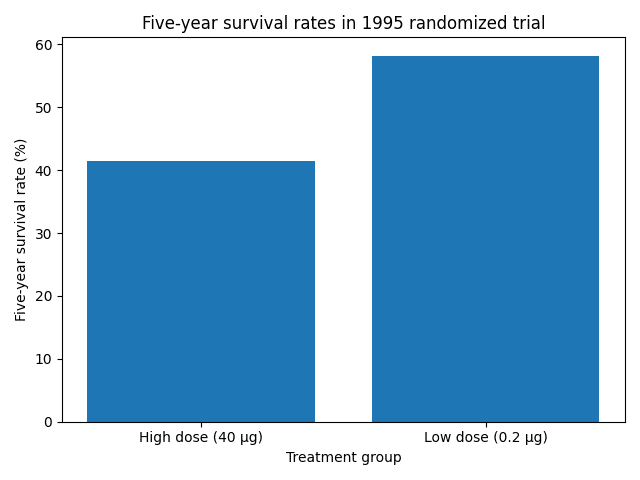
高用量投与が生存率を低下させた1995年試験(高用量40 µg vs 低用量0.2 µg)の結果を示します。この試験は思わぬ結果で、高用量群の方が低用量群よりも生存率が低くなりました。
2002〜2004年に行われたプラセボ対照試験では、低用量Z‑100群がプラセボ群に比べ若干高い生存率を示しましたが、有意差はありませんでした。下図は両群の5年生存率を比較したものです。
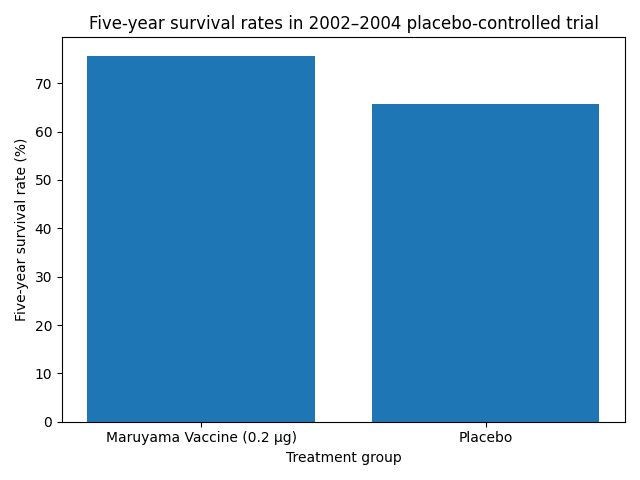
これらの結果から分かることは、丸山ワクチン単独または放射線療法との併用が、がん患者の生存期間を明確に延長するという高い質のエビデンスは存在しないということです。むしろ適切な用量設定や患者選択が重要であり、過量投与は不利益につながる可能性が示されました。
副作用と安全性
丸山ワクチンが長期間使われてきた背景には安全性の高さがあります。各臨床試験や患者報告から得られた特徴をまとめます。
- 重篤な副作用は極めてまれ – 骨髄抑制、脱毛、悪心・嘔吐などの抗がん剤特有の副作用は報告されていません。注射部位の疼痛や軽い発熱など局所反応が散発的に見られる程度です。
- 長期投与が可能 – 体力が低下した進行がん患者でも長期にわたり投与が続けられる例が多く、患者・家族の会では10年以上使用し続けている例も報告されています。
- 用量依存性への注意 – 高用量投与の臨床試験で生存率の低下が見られたことから、適正な用量での投与が求められます。臨床使用では治験担当医が患者の状態を観察しながら投与量を調整します。
問題点と議論
丸山ワクチンをめぐる最大の問題はエビデンスの不足です。体験談や症例報告では劇的な効果が語られる一方、無作為化比較試験では延命効果が証明されていません。このギャップがさまざまな議論を生んでいます。
- 科学的裏付けの不足 – 高品質なランダム化試験が少なく、多くは症例報告や小規模研究です。効果を検証する上で十分なデータが集まっていないことが承認の壁になっています。
- 制度上の特例扱い – 1981年の不承認後も患者の希望に応える形で有償治験薬として供給されています。これは国の薬事制度において極めて特殊な扱いであり、承認の有無と実際の使用がねじれた状態となっています。
- 体験談の影響 – 著名人や患者の体験談がメディアで紹介され、大きな期待を集めます。しかし体験談は科学的根拠にはならないため、効果を過大評価しない慎重さが必要です。
- 医療者の説明責任 – 標準治療が尽きた患者に対して丸山ワクチンを提案する際、効果が証明されていないことや費用負担があることを丁寧に説明し、患者の自己決定を尊重する姿勢が求められます。
最新の動向(2025年現在)
2025年9月時点でも丸山ワクチンの承認状況は変わっておらず、有償治験薬として使用されています。2020年代に実施されたとされる国際共同試験の結果はまだ公表されておらず、新たな有効性データは得られていません。したがって、最新の医学的評価に基づく治療選択を行うことが重要です。
まとめ
丸山ワクチンは、戦時中の結核治療研究から生まれた日本独自の免疫療法であり、副作用が少ないことから多くのがん患者に「最後の望み」として選ばれてきました。しかし、これまでに実施された臨床試験では生存期間や腫瘍縮小への明確な効果は確認されておらず、科学的な裏付けが乏しいことが最大の課題です。患者の期待と科学的証明のギャップを埋めるためには、より大規模かつ質の高い臨床試験が必要です。現時点で丸山ワクチンを検討する際は、標準治療を優先し、治験担当医と相談のうえメリットとリスクを十分に理解したうえで判断することをおすすめします。
参考文献
- Sugiyama T, et al. “Phase III placebo-controlled double-blind randomized trial of radiotherapy for stage IIB–IVA cervical cancer with or without immunomodulator Z-100”. Annals of Oncology 25, 1011–1017 (2014).
- Noda K, et al. “Randomized phase II study of immunomodulator Z-100 in patients with stage IIIB cervical cancer with radiation therapy.” Japanese Journal of Clinical Oncology 36, 570–577 (2006).
- 日本緩和医療学会編『がん補完代替医療ガイドライン 第1版』 (2008).
- 藤原恵一「丸山ワクチンのエビデンス構築」日本医事新報 (2016).
- 特定非営利活動法人 丸山ワクチンとがんを考える会 「丸山ワクチン(SSM)の研究概要」ウェブサイトssm-cancer.gr.jp.